


新闻资讯
J. Med. Chem. | 基于糖肽类抗生素的“氨基/胍基修饰策略”通过增强 “膜-壁双重抑制”克服细菌获得性耐药和固有耐药性
2024-11-08 16:28
2024年11月7日,烟台新药创制山东省实验室化学药物研究中心管栋梁团队联合陆军军医大学免疫制品国家工程研究中心章金勇团队在Journal of Medicinal Chemistry在线发表了题为“Single Amine or Guanidine Modification on Norvancomycin and Vancomycin to Overcome Multidrug-Resistance through Augmented Lipid II Binding and Increased Membrane Activity”的研究论文。该联合团队开发了基于万古霉素和去甲万古霉素的“单一氨基/胍基”修饰策略,有效的克服了耐药阳性菌的获得性耐药以及耐药阴性菌的天然耐药,并最终获得一个具有良好成药性的候选糖肽类抗生素药物分子4g。

抗生素耐药性是威胁全人类生命健康的重大威胁,也是一种逐渐逼近的大流行疫病。2019年抗生素耐药性造成了495万人的死亡,并且这一数字到2050年将预计达到1000万人。因此开发新型有效的针对耐药性细菌感染的抗生素药物是极其迫切的。
万古霉素和去甲万古霉素是糖肽类抗生素家族的重要成员,分别于1958年、1968年在美国和中国上市并应用于临床,主要用作对甲氧西林耐药的金黄色葡萄球菌(MRSA)等耐药阳性菌感染的治疗,被誉为人类对付顽固耐药阳性菌感染的“最后一道防线”。然而随着万古霉素的广泛使用,对其耐药的阳性菌菌株逐渐出现,并越来越多。由此,最后一道防线岌岌可危。而革兰氏阴性菌,因其独特的外膜屏障,使得其对于具有较大分子量(> 1400Da)的糖肽类抗生素无法有效穿过而天然耐药。氨基、胍基官能团在抗菌小分子药物中较为常见,通常因为其在生理条件下带有正电荷,与细胞膜有额外的相互作用,并能携带小分子渗透阴性菌外膜屏障到达靶点部位而起效,是一种有效的“药物再利用策略(drug repurpose)”,然而该策略在具有较大分子量的糖肽类结构上较少被研究。基于此,在本项工作中,研究人员提出了“氨基/胍基修饰策略”对糖肽类抗生素(万古霉素、去甲万古霉素)进行改造,希望借助氨基/胍基对细胞膜的活性,克服相应的获得性耐药对万古霉素耐药阳性菌重新恢复敏感性,同时克服阴性菌的固有耐药性进一步拓宽抗菌谱。
首先研究人员合理设计并合成了一系列带有单个胺或胍官能团的万古霉素类似物,改变了各种连接子和修饰位点,对构效关系(SAR)进行了广泛深入的探究(图1)。体外抗菌活性结果显示许多衍生物的抗菌活性大大增强,达到了万古霉素的4-128倍。更为有意思的是,这一改造策略使得万古霉素/去甲万古霉素拓宽了抗菌谱,对于部分阴性菌(大肠杆菌、鲍曼不动杆菌)显示出了良好活性(表1)。
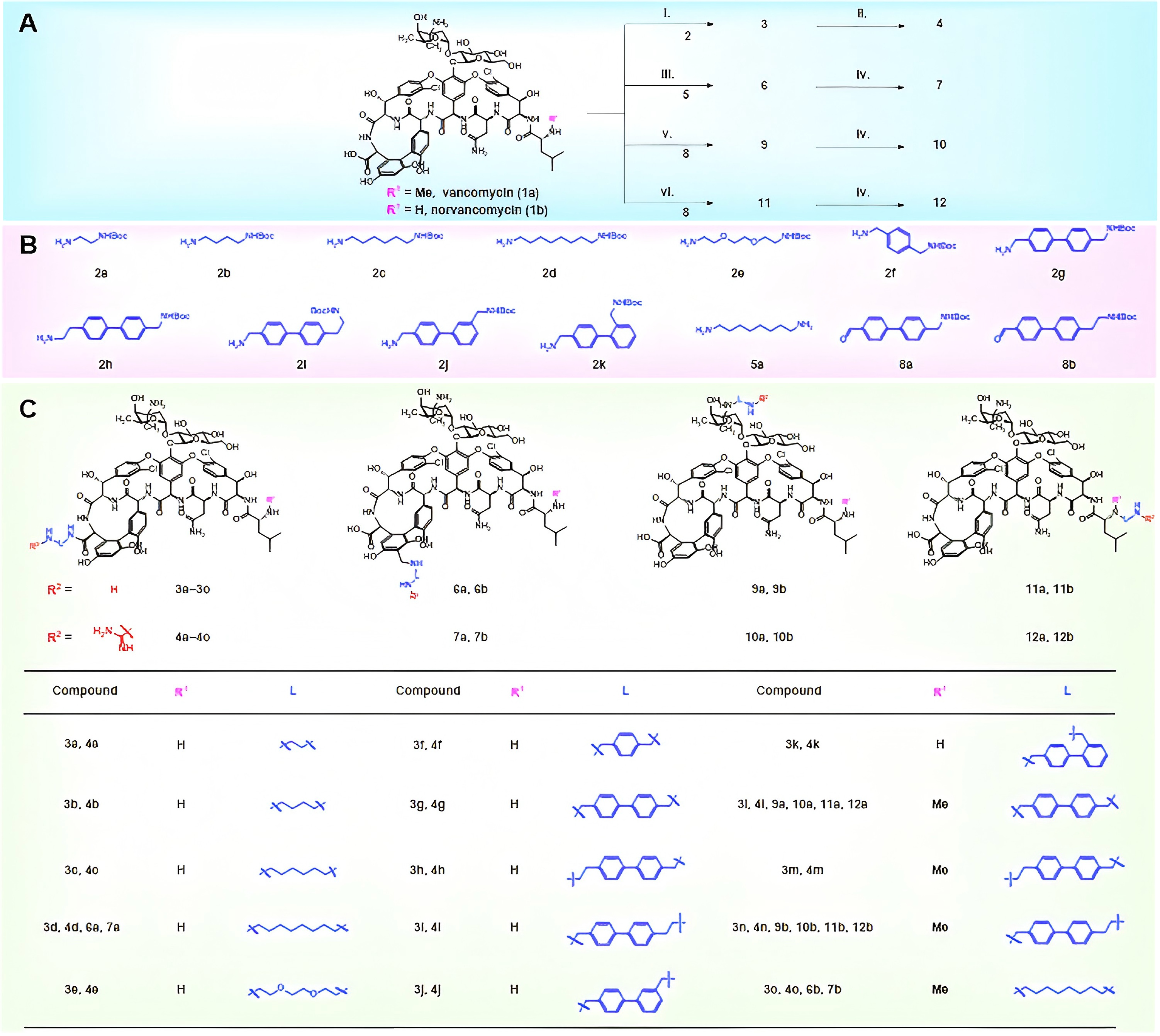
图1 氨基/胍基修饰的万古霉素类似物的设计与合成
表1 优选化合物的体外抗菌活性

[a] MSSA, methicillin-susceptible S. aureus; [b] VISA, vancomycin-intermediate S. aureus; [c] VREm (vanA), vancomycin-resistant E. faecium, Van A phenotype; [d] VREm (vanM), vancomycin-resistant E. faecium, VanM phenotype; [e] VREm (vanB), vancomycin-resistant E. faecium, VanB phenotype; [f] Eco, E. coli: Escherichia coli AB1157; [g] Aba, A. baumannii: Acinetobacter baumannii, CRAB-1, Carbapenem-resistant Acinetobacter baumannii, clinical isolate from RenJi hospital; [h] Kpn, K. pneumoniae: Klebsiella pneumoniae, KP-1, clinical isolate from RenJi hospital; [i] Pae, Pseudomonas aeruginosa PAO1.
最佳化合物 4g 表现出了更好的药代动力学和药效学特征,提示其具有较好的成药性,具有开发成候选新药的潜力。
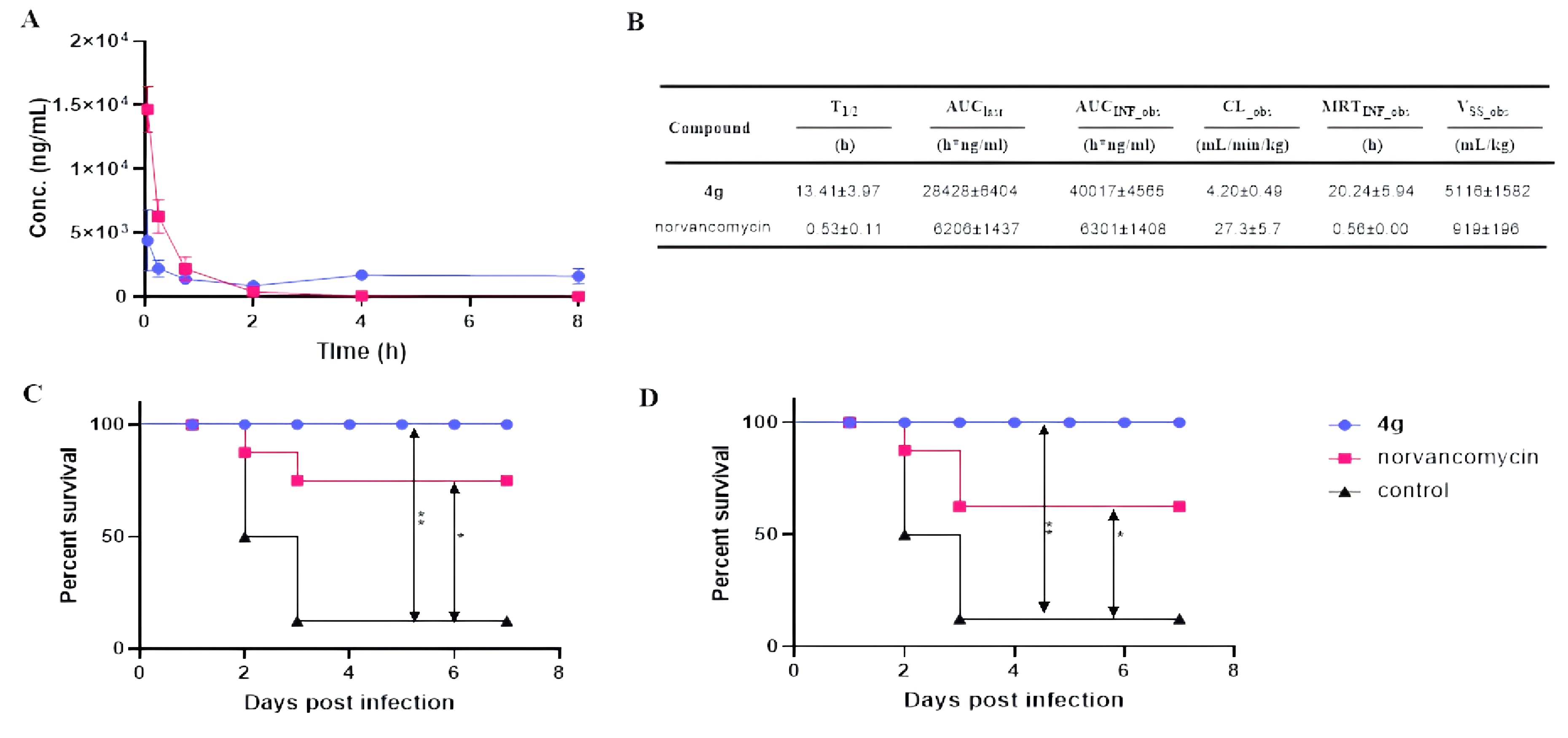
图2 优选化合物4g的体内药代和药效评价
作用机制研究揭示了 4g 的新颖作用机制(图3),解释了其有效克服耐药性的内在原因。其中在对抗耐药阳性菌方面,额外胍基化修饰的4g能够增加与细菌细胞膜的相互作用,造成通透性的提高和去极化。除此之外,4g还能够增加与Lipid II模拟肽的结合亲和力,进而增强了对细胞壁生物合成的抑制,造成了Park核苷酸的累积增加。而在对抗阴性菌方面,4g能够造成大肠杆菌外膜和内膜通透性的提高,克服固有耐药性,发挥抗阴性菌活性。
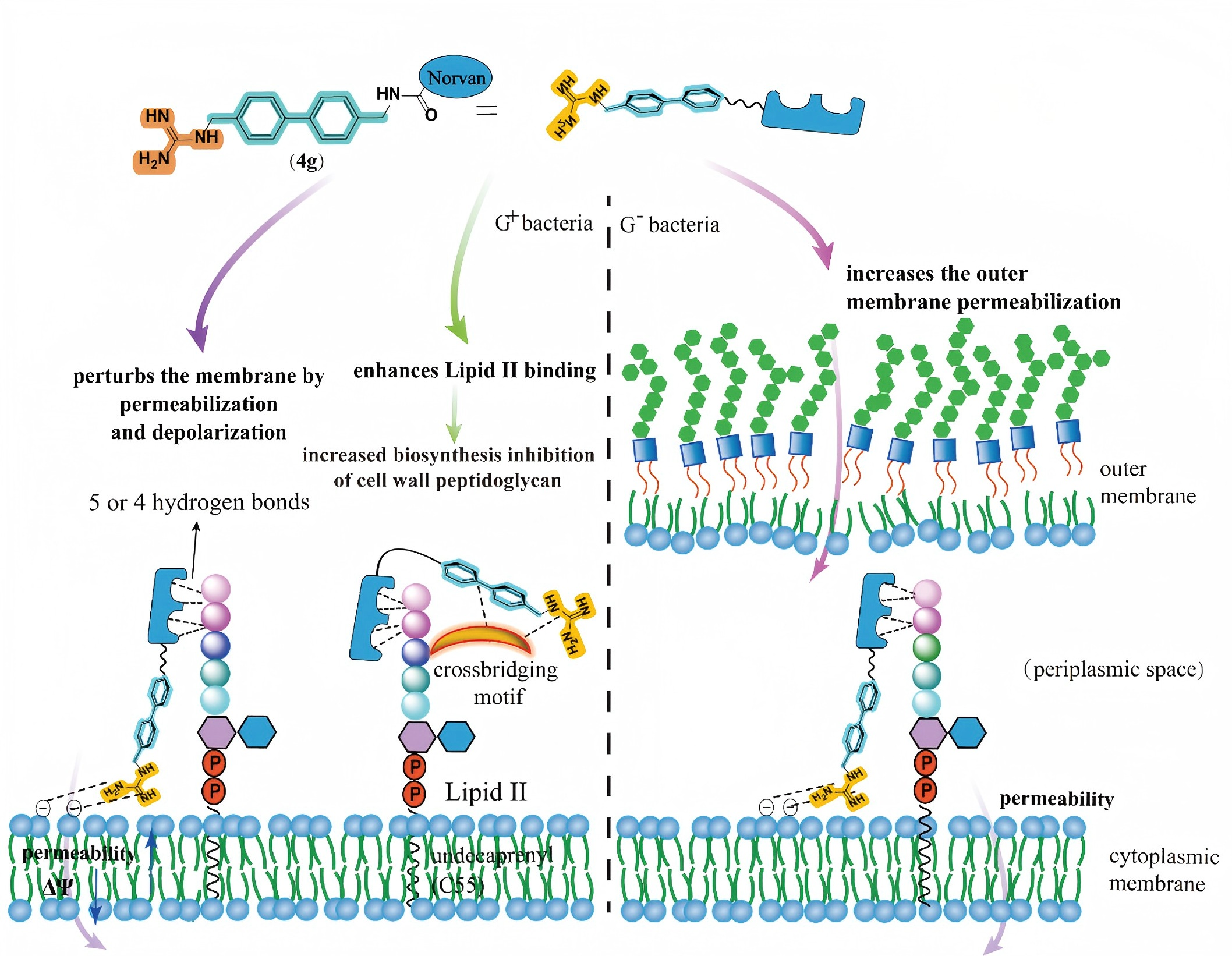
图3 优选化合物4g作用机制示意图
整体来说,本项研究为克服耐药性提供了一种新的策略和机制,有效拓宽了糖肽类抗生素抗菌谱,并且丰富了基于糖肽类抗生素的应急抗生素药物储备库。
烟台新药创制山东省实验室的科研助理卞晓磊和陆军军医大学的科研助理陈致富为论文的共同第一作者,烟台新药创制山东省实验室的管栋梁研究员、陆军军医大学的章金勇教授、管栋梁课题组博士后王晓文博士为共同通讯作者。同时感谢山东第二医科大学的张静文教授在安全性评价方面给予的大力支持,感谢中国科学院上海药物所的陈菲菲老师、湖南大学的冯欣欣教授对本研究中的部分生物实验的指导和帮助。该研究获得国家自然科学基金、烟台新药创制山东省实验室启动基金、上海市超级博士后基金、国家资助博士后研究人员计划C类的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c02196
供稿部门:管栋梁课题组
J. Med. Chem. | 基于糖肽类抗生素的“氨基/胍基修饰策略”通过增强 “膜-壁双重抑制”克服细菌获得性耐药和固有耐药性
2024-11-08 16:28
2024年11月7日,烟台新药创制山东省实验室化学药物研究中心管栋梁团队联合陆军军医大学免疫制品国家工程研究中心章金勇团队在Journal of Medicinal Chemistry在线发表了题为“Single Amine or Guanidine Modification on Norvancomycin and Vancomycin to Overcome Multidrug-Resistance through Augmented Lipid II Binding and Increased Membrane Activity”的研究论文。该联合团队开发了基于万古霉素和去甲万古霉素的“单一氨基/胍基”修饰策略,有效的克服了耐药阳性菌的获得性耐药以及耐药阴性菌的天然耐药,并最终获得一个具有良好成药性的候选糖肽类抗生素药物分子4g。

抗生素耐药性是威胁全人类生命健康的重大威胁,也是一种逐渐逼近的大流行疫病。2019年抗生素耐药性造成了495万人的死亡,并且这一数字到2050年将预计达到1000万人。因此开发新型有效的针对耐药性细菌感染的抗生素药物是极其迫切的。
万古霉素和去甲万古霉素是糖肽类抗生素家族的重要成员,分别于1958年、1968年在美国和中国上市并应用于临床,主要用作对甲氧西林耐药的金黄色葡萄球菌(MRSA)等耐药阳性菌感染的治疗,被誉为人类对付顽固耐药阳性菌感染的“最后一道防线”。然而随着万古霉素的广泛使用,对其耐药的阳性菌菌株逐渐出现,并越来越多。由此,最后一道防线岌岌可危。而革兰氏阴性菌,因其独特的外膜屏障,使得其对于具有较大分子量(> 1400Da)的糖肽类抗生素无法有效穿过而天然耐药。氨基、胍基官能团在抗菌小分子药物中较为常见,通常因为其在生理条件下带有正电荷,与细胞膜有额外的相互作用,并能携带小分子渗透阴性菌外膜屏障到达靶点部位而起效,是一种有效的“药物再利用策略(drug repurpose)”,然而该策略在具有较大分子量的糖肽类结构上较少被研究。基于此,在本项工作中,研究人员提出了“氨基/胍基修饰策略”对糖肽类抗生素(万古霉素、去甲万古霉素)进行改造,希望借助氨基/胍基对细胞膜的活性,克服相应的获得性耐药对万古霉素耐药阳性菌重新恢复敏感性,同时克服阴性菌的固有耐药性进一步拓宽抗菌谱。
首先研究人员合理设计并合成了一系列带有单个胺或胍官能团的万古霉素类似物,改变了各种连接子和修饰位点,对构效关系(SAR)进行了广泛深入的探究(图1)。体外抗菌活性结果显示许多衍生物的抗菌活性大大增强,达到了万古霉素的4-128倍。更为有意思的是,这一改造策略使得万古霉素/去甲万古霉素拓宽了抗菌谱,对于部分阴性菌(大肠杆菌、鲍曼不动杆菌)显示出了良好活性(表1)。

图1 氨基/胍基修饰的万古霉素类似物的设计与合成
表1 优选化合物的体外抗菌活性

[a] MSSA, methicillin-susceptible S. aureus; [b] VISA, vancomycin-intermediate S. aureus; [c] VREm (vanA), vancomycin-resistant E. faecium, Van A phenotype; [d] VREm (vanM), vancomycin-resistant E. faecium, VanM phenotype; [e] VREm (vanB), vancomycin-resistant E. faecium, VanB phenotype; [f] Eco, E. coli: Escherichia coli AB1157; [g] Aba, A. baumannii: Acinetobacter baumannii, CRAB-1, Carbapenem-resistant Acinetobacter baumannii, clinical isolate from RenJi hospital; [h] Kpn, K. pneumoniae: Klebsiella pneumoniae, KP-1, clinical isolate from RenJi hospital; [i] Pae, Pseudomonas aeruginosa PAO1.
最佳化合物 4g 表现出了更好的药代动力学和药效学特征,提示其具有较好的成药性,具有开发成候选新药的潜力。

图2 优选化合物4g的体内药代和药效评价
作用机制研究揭示了 4g 的新颖作用机制(图3),解释了其有效克服耐药性的内在原因。其中在对抗耐药阳性菌方面,额外胍基化修饰的4g能够增加与细菌细胞膜的相互作用,造成通透性的提高和去极化。除此之外,4g还能够增加与Lipid II模拟肽的结合亲和力,进而增强了对细胞壁生物合成的抑制,造成了Park核苷酸的累积增加。而在对抗阴性菌方面,4g能够造成大肠杆菌外膜和内膜通透性的提高,克服固有耐药性,发挥抗阴性菌活性。

图3 优选化合物4g作用机制示意图
整体来说,本项研究为克服耐药性提供了一种新的策略和机制,有效拓宽了糖肽类抗生素抗菌谱,并且丰富了基于糖肽类抗生素的应急抗生素药物储备库。
烟台新药创制山东省实验室的科研助理卞晓磊和陆军军医大学的科研助理陈致富为论文的共同第一作者,烟台新药创制山东省实验室的管栋梁研究员、陆军军医大学的章金勇教授、管栋梁课题组博士后王晓文博士为共同通讯作者。同时感谢山东第二医科大学的张静文教授在安全性评价方面给予的大力支持,感谢中国科学院上海药物所的陈菲菲老师、湖南大学的冯欣欣教授对本研究中的部分生物实验的指导和帮助。该研究获得国家自然科学基金、烟台新药创制山东省实验室启动基金、上海市超级博士后基金、国家资助博士后研究人员计划C类的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c02196
供稿部门:管栋梁课题组