


新闻资讯
JACS | 烟台新药创制山东省实验室发现海洋活性天然产物抗急性肺损伤新功能及其相关药物作用新靶标
2024-09-30 23:33
2024年9月16日,烟台新药创制山东省实验室海洋药物研发中心郭跃伟/李序文研究团队联合中国药科大学多靶标天然药物全国重点实验室庞涛研究团队在Journal of the American Chemical Society上发表题为《Chemoproteomics of Marine Natural Product Naamidine J Unveils CSE1L as a Therapeutic Target in Acute Lung Injury》的最新研究成果。该研究通过化学蛋白质组学结合ABPP技术发现了海洋天然产物naamidine J (NJ)抗炎新功能的直接靶标为CSE1L,并通过定量蛋白质组学、分子生物学和过继转移等实验揭示了NJ通过作用于CSE1L靶标H745和F903位点,从而抑制SP1的核易位和转录活性,进而发挥抗炎和抗急性肺损伤的治疗效果。

肺泡巨噬细胞是肺泡间隙的哨兵细胞,是肺组织先天性免疫系统的第一道防线,具有细胞膜和细胞膜受体,对任何入侵的病原体都处于“高度警戒 ”状态,在维持体内平衡、抵御病原体和控制肺部炎症方面发挥着重要作用。在急性肺损伤的炎症疾病中,过度激活的巨噬细胞和被巨噬细胞招募的中性粒细胞会产生大量的促炎细胞因子,导致细胞因子风暴,从而导致严重的细胞死亡和肺组织损伤。此外,巨噬细胞还可通过改变巨噬细胞的极化状态或通过分泌各种细胞因子和化学介质与其他细胞相互作用来修复受损组织。越来越多的研究证据表明,干预失控的严重炎症反应是治疗急性肺损伤等炎症性疾病最有效的疗法之一。
本研究中,研究人员首次发现了NJ具有良好的抗炎活性,对其及相关天然产物检索发现,其化学结构不统一。因此,研究人员首先全合成了NJ及其同系列海洋生物碱,并采用DFT和X-Ray对该类化合物的结构进行了修正,为该类化合物未来的构效关系分析和靶标位点的确证提供了前提。在明确NJ的体外抗炎活性和体内抗小鼠急性肺损伤功能之后,作者基于ABPP策略联合化学蛋白质组学技术手段发现了NJ的靶标蛋白CSE1L,通过CETSA和SPR实验确证了NJ和CSE1L的结合。并通过亲和标记实验和位点突变实验发现NJ直接作用CSE1L 745位的His和903位的Phe。进一步,基于CSE1L的生物功能,研究人员通过核/质定量蛋白质组学、分子生物学和药理学的相关实验方法发现了NJ是通过结合CSE1L来调控SP1的核易位和转录活性,进而发挥抗炎生物活性。最后,作者在小鼠体内耗竭了巨噬细胞,通过过继转移CSE1L敲低的巨噬细胞更进一步证明了NJ在体内也是通过CSE1L发现抗炎和抗急性肺损伤生物活性的。该研究为治疗急性肺损伤提供了一个新的药理学靶点,也为研究CSE1L的功能和开发治疗急性肺损伤的候选化合物物提供了一个可用的化学工具。
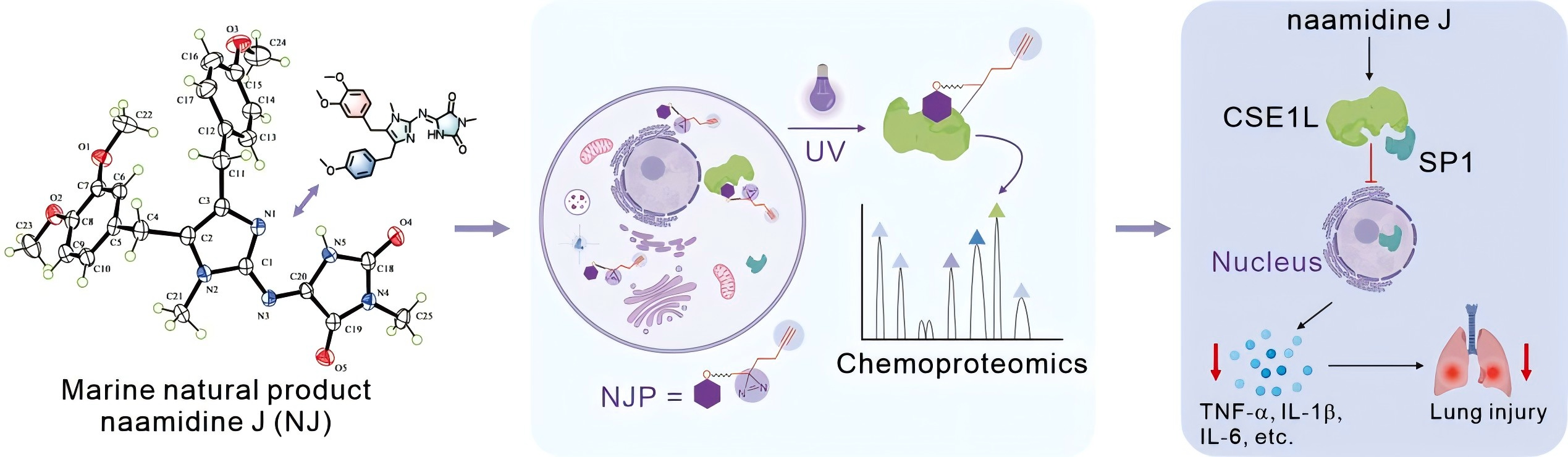
图 海洋天然产物 NJ的化学蛋白质组学揭示急性肺损伤的治疗靶点CSE1L (TOC graphic)
烟台新药创制山东省实验室博士后高成龙(中国药科大学2022届博士毕业生),中国药科大学宋锦乾博士研究生,中国科学院上海药物研究所硕士研究生杨泽楠为本文共同第一作者。烟台新药创制山东省实验室李序文研究员,中国药科大学庞涛研究员,烟台新药创制山东省实验室/上海大学郭跃伟研究员为本文共同通讯作者。该工作得到国家重点研发计划,国家自然科学基金,中国博士后科学基金,中国药科大学双一流建设项目,山东省泰山学者工程,上海市科学技术委员会和烟台市科技创新与发展计划基础研究项目等资助。特别感谢中国科学院上海药物研究所陈凯先院士,天津大学张向阳教授和高妍老师,以及中国海洋大学李国强教授对本文提供的指导和帮助。
全文链接:https://doi.org/10.1021/jacs.4c09695
(供稿部门:李序文课题组)
JACS | 烟台新药创制山东省实验室发现海洋活性天然产物抗急性肺损伤新功能及其相关药物作用新靶标
2024-09-30 23:33
2024年9月16日,烟台新药创制山东省实验室海洋药物研发中心郭跃伟/李序文研究团队联合中国药科大学多靶标天然药物全国重点实验室庞涛研究团队在Journal of the American Chemical Society上发表题为《Chemoproteomics of Marine Natural Product Naamidine J Unveils CSE1L as a Therapeutic Target in Acute Lung Injury》的最新研究成果。该研究通过化学蛋白质组学结合ABPP技术发现了海洋天然产物naamidine J (NJ)抗炎新功能的直接靶标为CSE1L,并通过定量蛋白质组学、分子生物学和过继转移等实验揭示了NJ通过作用于CSE1L靶标H745和F903位点,从而抑制SP1的核易位和转录活性,进而发挥抗炎和抗急性肺损伤的治疗效果。

肺泡巨噬细胞是肺泡间隙的哨兵细胞,是肺组织先天性免疫系统的第一道防线,具有细胞膜和细胞膜受体,对任何入侵的病原体都处于“高度警戒 ”状态,在维持体内平衡、抵御病原体和控制肺部炎症方面发挥着重要作用。在急性肺损伤的炎症疾病中,过度激活的巨噬细胞和被巨噬细胞招募的中性粒细胞会产生大量的促炎细胞因子,导致细胞因子风暴,从而导致严重的细胞死亡和肺组织损伤。此外,巨噬细胞还可通过改变巨噬细胞的极化状态或通过分泌各种细胞因子和化学介质与其他细胞相互作用来修复受损组织。越来越多的研究证据表明,干预失控的严重炎症反应是治疗急性肺损伤等炎症性疾病最有效的疗法之一。
本研究中,研究人员首次发现了NJ具有良好的抗炎活性,对其及相关天然产物检索发现,其化学结构不统一。因此,研究人员首先全合成了NJ及其同系列海洋生物碱,并采用DFT和X-Ray对该类化合物的结构进行了修正,为该类化合物未来的构效关系分析和靶标位点的确证提供了前提。在明确NJ的体外抗炎活性和体内抗小鼠急性肺损伤功能之后,作者基于ABPP策略联合化学蛋白质组学技术手段发现了NJ的靶标蛋白CSE1L,通过CETSA和SPR实验确证了NJ和CSE1L的结合。并通过亲和标记实验和位点突变实验发现NJ直接作用CSE1L 745位的His和903位的Phe。进一步,基于CSE1L的生物功能,研究人员通过核/质定量蛋白质组学、分子生物学和药理学的相关实验方法发现了NJ是通过结合CSE1L来调控SP1的核易位和转录活性,进而发挥抗炎生物活性。最后,作者在小鼠体内耗竭了巨噬细胞,通过过继转移CSE1L敲低的巨噬细胞更进一步证明了NJ在体内也是通过CSE1L发现抗炎和抗急性肺损伤生物活性的。该研究为治疗急性肺损伤提供了一个新的药理学靶点,也为研究CSE1L的功能和开发治疗急性肺损伤的候选化合物物提供了一个可用的化学工具。

图 海洋天然产物 NJ的化学蛋白质组学揭示急性肺损伤的治疗靶点CSE1L (TOC graphic)
烟台新药创制山东省实验室博士后高成龙(中国药科大学2022届博士毕业生),中国药科大学宋锦乾博士研究生,中国科学院上海药物研究所硕士研究生杨泽楠为本文共同第一作者。烟台新药创制山东省实验室李序文研究员,中国药科大学庞涛研究员,烟台新药创制山东省实验室/上海大学郭跃伟研究员为本文共同通讯作者。该工作得到国家重点研发计划,国家自然科学基金,中国博士后科学基金,中国药科大学双一流建设项目,山东省泰山学者工程,上海市科学技术委员会和烟台市科技创新与发展计划基础研究项目等资助。特别感谢中国科学院上海药物研究所陈凯先院士,天津大学张向阳教授和高妍老师,以及中国海洋大学李国强教授对本文提供的指导和帮助。
全文链接:https://doi.org/10.1021/jacs.4c09695
(供稿部门:李序文课题组)