


新闻资讯
J. Med. Chem.封面 | 烟台新药创制山东省实验室首次发现海洋西松烷内酯在溃疡性结肠炎的应用
2024-08-06 17:08
2024年7月25日,烟台新药创制山东省实验室海洋药物研究中心郭跃伟/李序文团队联合代谢性疾病药物研究中心李佳团队在Journal of Medicinal Chemistry上发表了题为《The First Discovery of Marine Polyoxygenated Cembranolides as Potential Agents for the Treatment of Ulcerative Colitis》的最新研究成果,并被选为补充封面文章。合作团队对海洋软珊瑚中典型西松烷二萜类分子进行了定向挖掘和系统构效关系分析,并对抗炎机制和体内抗UC药效评价做了深入研究,充分展示了海洋天然产物—西松烷内酯可作为治疗溃疡性结肠炎药物的候选分子。

溃疡性结肠炎(Ulcerative Colitis, UC)是一种肠道慢性非特异性炎症性疾病,病变多位于乙状结肠和直肠,也可延伸至降结肠,甚至整个结肠,病程漫长,常反复发作,临床表现为血便、腹泻和腹痛。UC在全球发病率日益上升,尤其是在亚洲和非洲等许多新兴工业化地区。尽管UC的病因仍然不明确,但人们普遍认为该疾病的发生是外源物质引起宿主反应、基因和免疫三者相互作用的结果,病理机制涉及粘膜免疫系统稳态紊乱和肠上皮屏障受损。目前,可以采用手术的方法或使用皮质类固醇、氨基水杨酸和抗生素等传统药物治疗UC,但这些药物仍存在严重的
不良反应,并且成本较高,而且只能在短期内缓解病情,无法实现疾病治愈和长期的预防。因此,迫切需要以全新的视角开发新型的UC治疗药物。

在该项研究中,研究人员首先利用基于HSQC的SMART导向技术,从中国南海软珊瑚Sinularia pedunculata中快速、精准定位具有特征结构的馏分,并从中分离出31个西松烷二萜,含6个新化合物,其中包括21个西松烷内酯。值得关注的是,sinupedunolide A (1) 具有罕见的在C-4和C-9位形成的过氧桥。同样有趣的是,sinupedunol A (2) 具有少见的七元醚环,而不具备α, β-不饱和内酯的结构片段。除了新颖化合物的发现,大样本量且结构多样的西松烷二萜的获得也为后续系统构效关系分析提供了坚实基础。
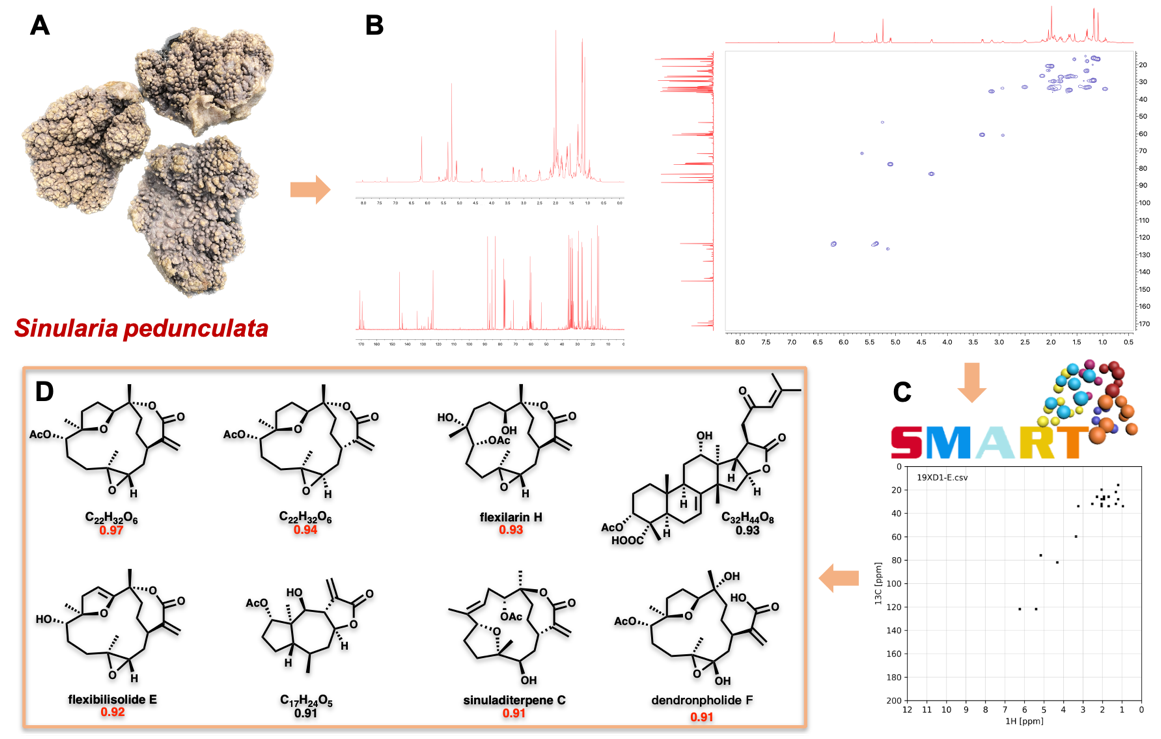
图1. 基于HSQC的SMART快速导向分离
巨噬细胞极化在炎症的进展中起着重要作用,通常由LPS诱导,特征是诱导型一氧化氮合酶(iNOS)的高表达、NO的产生和促炎细胞因子的分泌。由于西松烷二萜有过抗炎活性的报道,为了进一步系统研究它们的潜在抗炎功效,研究人员测试了分离所得的31个西松烷二萜对LPS诱导的RAW264.7细胞中NO产生的抑制作用,结果表明具有α, β-不饱和内酯的西松烷二萜普遍具有显著的生物活性,其IC50值在亚微摩尔级别。构效分析表明,内酯片段是重要的活性来源,3,4位环氧的存在对活性有益。此外,C-11位的β取代显示出更好的活性,而在C-4至C-8的氧化对活性帮助不大,甚至可能导致活性的丧失。值得注意的是,化合物8和9表现出最优的抗炎活性,可显著抑制多种促炎细胞因子的转录和分泌。
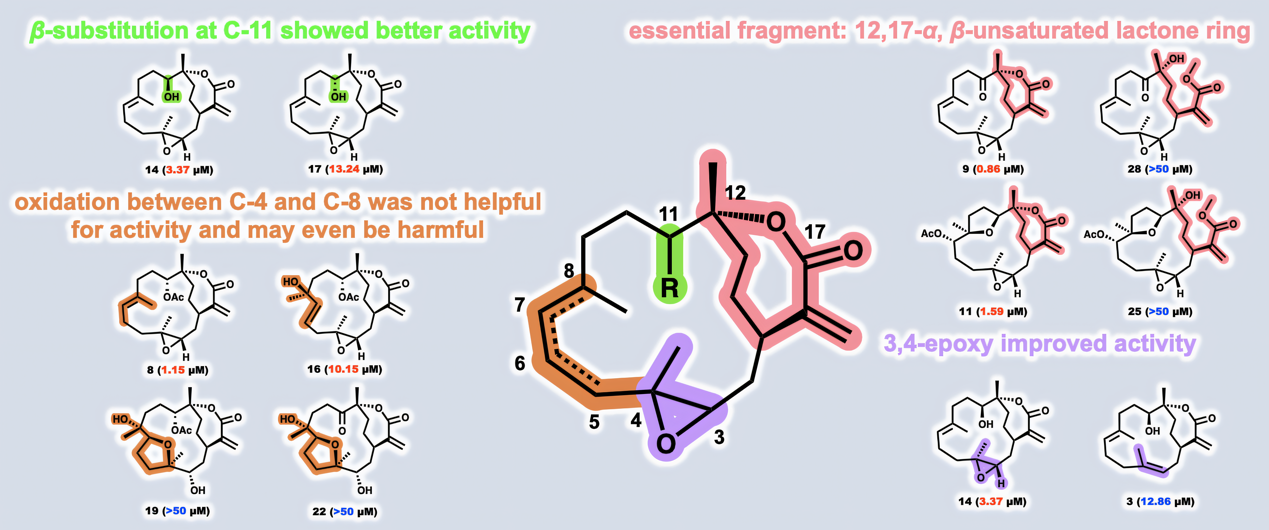
图2. 西松烷二萜的构效关系分析
进一步机制研究发现化合物8和9显著抑制了NF-κB的转录活性,降低p65、ERK和JNK的磷酸化,抑制NF-κB和MAPK信号通路,从而减少炎症因子的产生。更为重要的是,在葡聚糖硫酸钠(DSS)诱导的小鼠急性溃疡性肠炎模型中,化合物8和9可以有效缓解结肠炎症,显著降低疾病活动指数(DAI)评分,及H&E组织病理学评分,同时抑制结肠中炎症细胞因子的表达,并改善肠道屏障的完整性。
总之,这项完全基于天然产物的化学多样性所开展的纯天然药物化学研究首次深入探索了海洋分子—西松烷内酯对UC的作用机制及其体内药效,为西松烷内酯成为进一步开发创新型UC药物提供了新的分子模板和骨架参考。
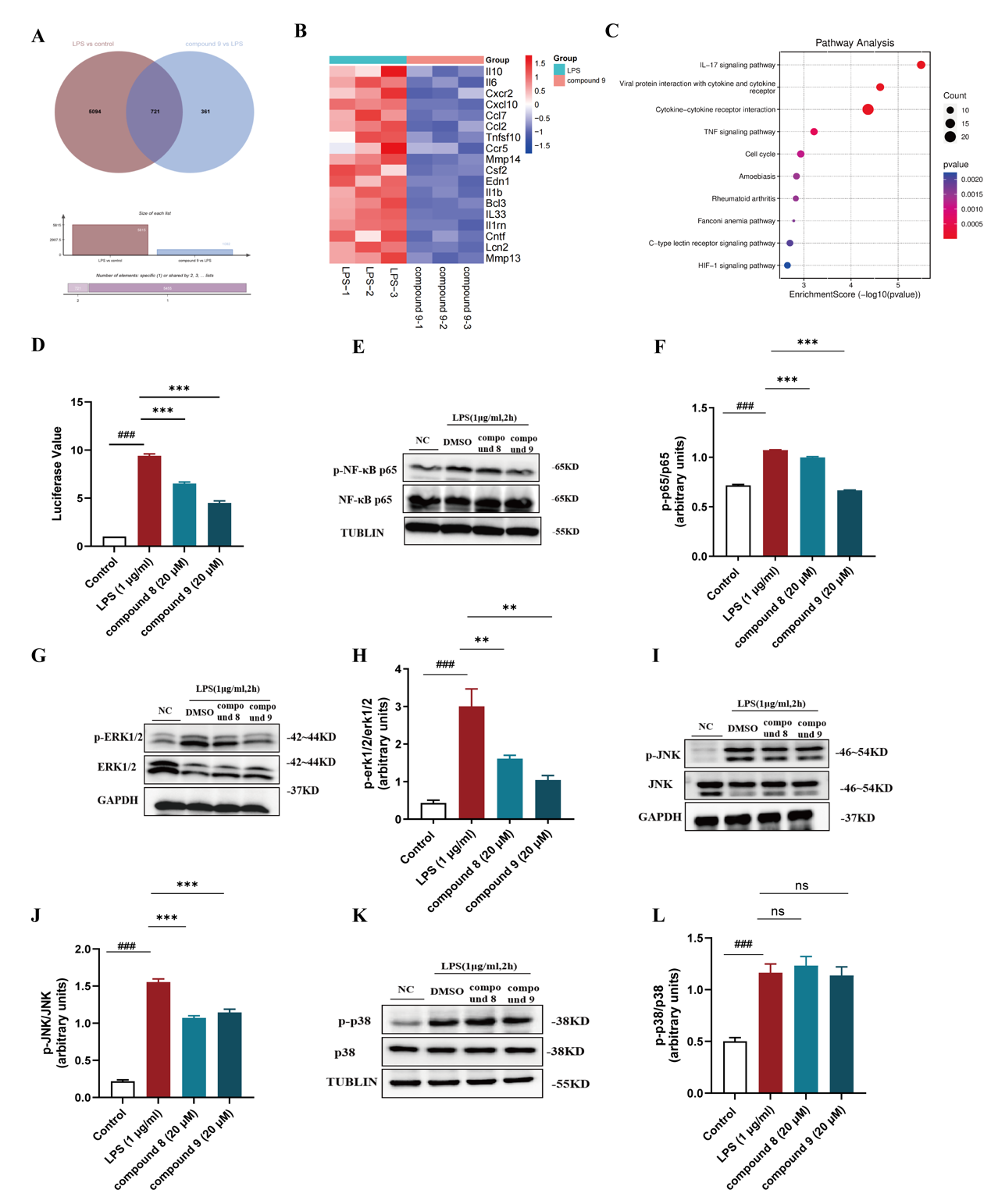
图3. 化合物8和9抑制NF-κB和MAPK信号通路
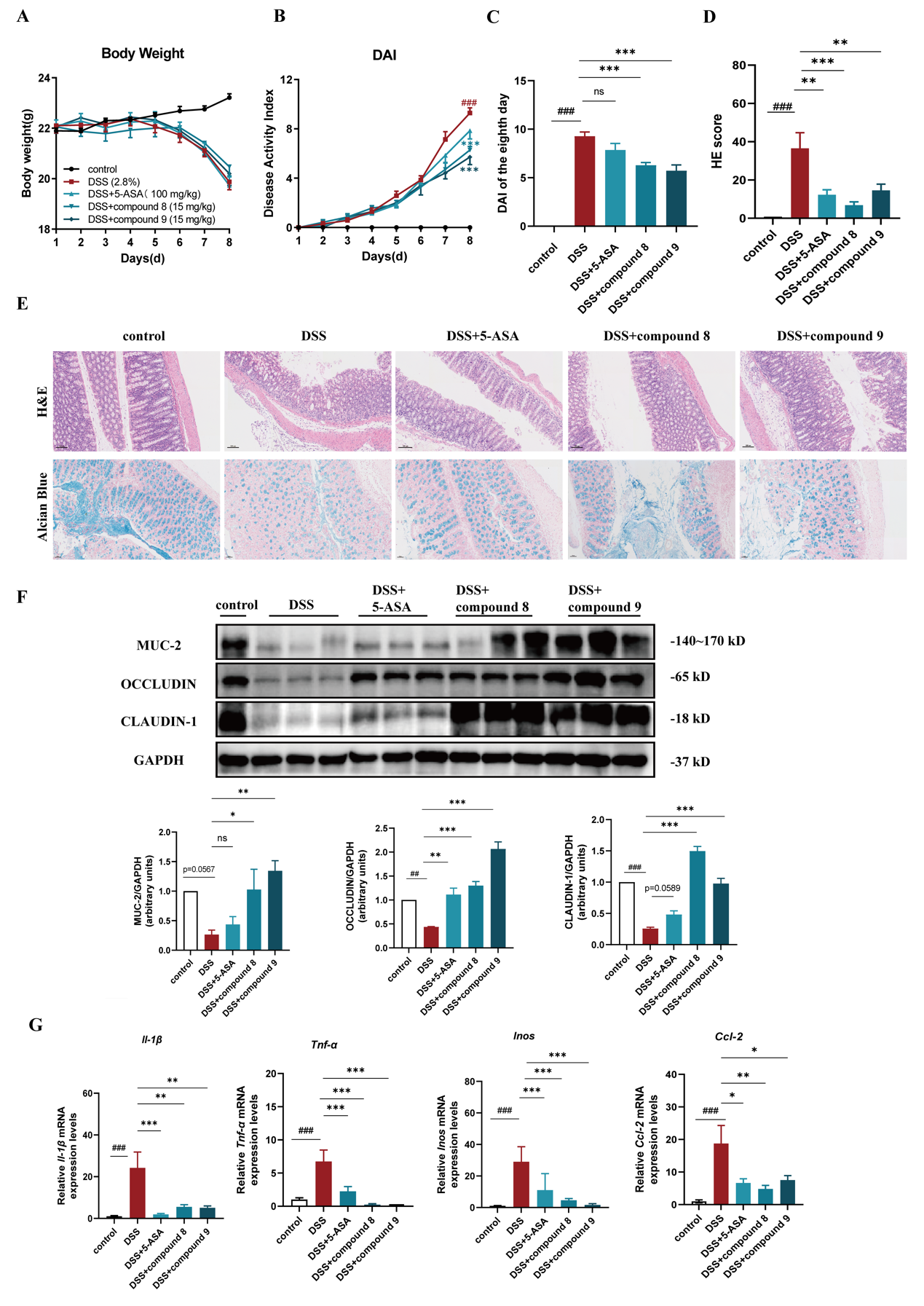
图4. 化合物8和9改善DSS诱导的急性肠炎小鼠模型
中国药科大学和上海药物所联合培养硕士研究生崔媛媛、南京中医药大学和上海药物所联合培养硕士研究生金洋(现中山大学和上海药物所联合培养博士研究生)和上海药物所硕士研究生孙若楠为本文共同第一作者,烟台新药创制山东省实验室李序文研究员、李佳研究员、郭跃伟研究员和孙一立副研究员为本文共同通讯作者。该工作得到国家重点研发计划,国家自然科学基金,山东省泰山学者工程,山东省实验室专项项目,中国科学院青年交叉团队项目,上海市科学技术委员会和烟台市科技创新与发展计划基础研究项目的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00950
(供稿部门:李序文课题组)
J. Med. Chem.封面 | 烟台新药创制山东省实验室首次发现海洋西松烷内酯在溃疡性结肠炎的应用
2024-08-06 17:08
2024年7月25日,烟台新药创制山东省实验室海洋药物研究中心郭跃伟/李序文团队联合代谢性疾病药物研究中心李佳团队在Journal of Medicinal Chemistry上发表了题为《The First Discovery of Marine Polyoxygenated Cembranolides as Potential Agents for the Treatment of Ulcerative Colitis》的最新研究成果,并被选为补充封面文章。合作团队对海洋软珊瑚中典型西松烷二萜类分子进行了定向挖掘和系统构效关系分析,并对抗炎机制和体内抗UC药效评价做了深入研究,充分展示了海洋天然产物—西松烷内酯可作为治疗溃疡性结肠炎药物的候选分子。

溃疡性结肠炎(Ulcerative Colitis, UC)是一种肠道慢性非特异性炎症性疾病,病变多位于乙状结肠和直肠,也可延伸至降结肠,甚至整个结肠,病程漫长,常反复发作,临床表现为血便、腹泻和腹痛。UC在全球发病率日益上升,尤其是在亚洲和非洲等许多新兴工业化地区。尽管UC的病因仍然不明确,但人们普遍认为该疾病的发生是外源物质引起宿主反应、基因和免疫三者相互作用的结果,病理机制涉及粘膜免疫系统稳态紊乱和肠上皮屏障受损。目前,可以采用手术的方法或使用皮质类固醇、氨基水杨酸和抗生素等传统药物治疗UC,但这些药物仍存在严重的
不良反应,并且成本较高,而且只能在短期内缓解病情,无法实现疾病治愈和长期的预防。因此,迫切需要以全新的视角开发新型的UC治疗药物。

在该项研究中,研究人员首先利用基于HSQC的SMART导向技术,从中国南海软珊瑚Sinularia pedunculata中快速、精准定位具有特征结构的馏分,并从中分离出31个西松烷二萜,含6个新化合物,其中包括21个西松烷内酯。值得关注的是,sinupedunolide A (1) 具有罕见的在C-4和C-9位形成的过氧桥。同样有趣的是,sinupedunol A (2) 具有少见的七元醚环,而不具备α, β-不饱和内酯的结构片段。除了新颖化合物的发现,大样本量且结构多样的西松烷二萜的获得也为后续系统构效关系分析提供了坚实基础。

图1. 基于HSQC的SMART快速导向分离
巨噬细胞极化在炎症的进展中起着重要作用,通常由LPS诱导,特征是诱导型一氧化氮合酶(iNOS)的高表达、NO的产生和促炎细胞因子的分泌。由于西松烷二萜有过抗炎活性的报道,为了进一步系统研究它们的潜在抗炎功效,研究人员测试了分离所得的31个西松烷二萜对LPS诱导的RAW264.7细胞中NO产生的抑制作用,结果表明具有α, β-不饱和内酯的西松烷二萜普遍具有显著的生物活性,其IC50值在亚微摩尔级别。构效分析表明,内酯片段是重要的活性来源,3,4位环氧的存在对活性有益。此外,C-11位的β取代显示出更好的活性,而在C-4至C-8的氧化对活性帮助不大,甚至可能导致活性的丧失。值得注意的是,化合物8和9表现出最优的抗炎活性,可显著抑制多种促炎细胞因子的转录和分泌。

图2. 西松烷二萜的构效关系分析
进一步机制研究发现化合物8和9显著抑制了NF-κB的转录活性,降低p65、ERK和JNK的磷酸化,抑制NF-κB和MAPK信号通路,从而减少炎症因子的产生。更为重要的是,在葡聚糖硫酸钠(DSS)诱导的小鼠急性溃疡性肠炎模型中,化合物8和9可以有效缓解结肠炎症,显著降低疾病活动指数(DAI)评分,及H&E组织病理学评分,同时抑制结肠中炎症细胞因子的表达,并改善肠道屏障的完整性。
总之,这项完全基于天然产物的化学多样性所开展的纯天然药物化学研究首次深入探索了海洋分子—西松烷内酯对UC的作用机制及其体内药效,为西松烷内酯成为进一步开发创新型UC药物提供了新的分子模板和骨架参考。

图3. 化合物8和9抑制NF-κB和MAPK信号通路

图4. 化合物8和9改善DSS诱导的急性肠炎小鼠模型
中国药科大学和上海药物所联合培养硕士研究生崔媛媛、南京中医药大学和上海药物所联合培养硕士研究生金洋(现中山大学和上海药物所联合培养博士研究生)和上海药物所硕士研究生孙若楠为本文共同第一作者,烟台新药创制山东省实验室李序文研究员、李佳研究员、郭跃伟研究员和孙一立副研究员为本文共同通讯作者。该工作得到国家重点研发计划,国家自然科学基金,山东省泰山学者工程,山东省实验室专项项目,中国科学院青年交叉团队项目,上海市科学技术委员会和烟台市科技创新与发展计划基础研究项目的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00950
(供稿部门:李序文课题组)