


新闻资讯
用于NIR-II成像的有机单分子纳米平台肿瘤的化学光热协同治疗
2022-07-08 14:25
癌症是严重威胁人类健康的恶性疾病之一,也是致死的主要原因,氮芥作为烷化剂的发现开创了癌症化疗的发展。然而,由于癌细胞具有固有的DNA修复能力并产生耐药性,芥子氮衍生物产生的抗肿瘤作用可能会降低。
作为一种新兴的治疗方式,肿瘤光热治疗以无创和可控的方式靶向消融肿瘤组织。与具有长期体内毒性的无机光热剂相比,有机光热剂具有很高的临床应用潜力。但由于某些癌细胞具有获得的耐热性,仅用PTT治疗会留下微小的残留癌细胞,导致癌症复发。因此联合化疗和光热治疗的多功能光疗疗法是治疗肿瘤的有效方式。而先前报道的与化学光热疗法相结合的光疗材料的制备主要是通过将光热剂、荧光团和抗肿瘤药物如顺铂或阿霉素封装在一个纳米颗粒中,由于其成分复杂、重现性降低和药代动力学不确定,因此难以在临床中应用。
烟台新药创制山东省实验室程震研究员团队在肿瘤化学/光热治疗及生物应用领域取得最新进展。
研究者设计合成了一种新型化合物NM(如图1所示),该化合物将NIR-II FLI、化疗和光热处理能力整合到单分子系统中,合成了具有诊断功能和治疗的诊疗(Theranosic)探针。通过包封NM和两亲聚合物DSPE-PEG2000制备了水溶性NM基纳米颗粒(NM NP)以改善其疏水性。NM NP不仅具有超过1100nm的发射波长,并且作为具有深穿透深度和高时空分辨率的优秀NIRII荧光成像纳米探针,可以被应用于恶性肿瘤的协同化学光热治疗肿。生物相容性评估实验也证明了NM NP具有可忽略的生物毒性因此展现出重要的临床应用前景。
相关成果于2022年7月8日以“ Organic single molecule based nano-platform for NIR-II imaging and chemo-photothermal synergistic treatment of tumor”为题发表在国际知名学术期刊 Biomaterials上。
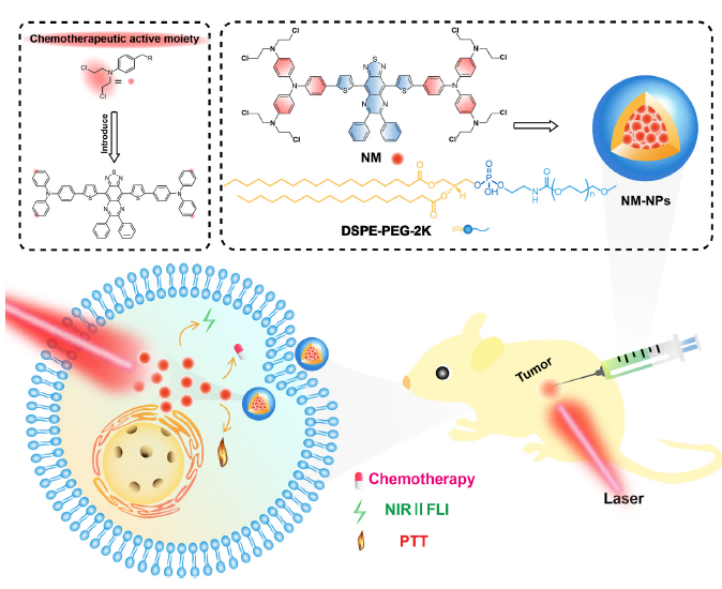
图1 用于NIR-II成像和光化学治疗的单分子纳米平台设计
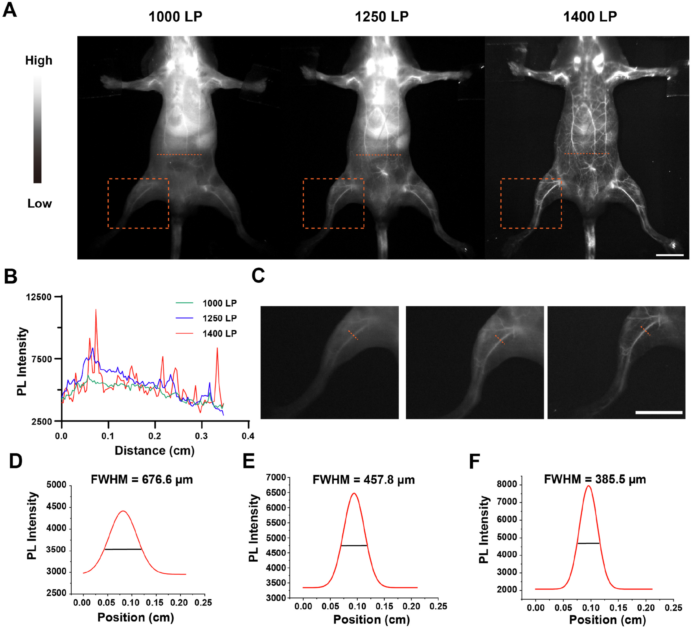
图2 NM NP的NIR-II荧光成像特性 (A)在808nm激发光(160 mW·cm-2)下NM NP进行体内NIR-II荧光成像,1000 LP滤光片(左侧,100 ms曝光时间),1250 LP滤光片(中间,500 ms曝光时间,1400 LP滤光片(右侧,1000 ms曝光时间,比例尺:1 cm。(B)图为对(A)中所标记的橙色虚线上的荧光强度分布分析(C)小鼠右后肢的放大图像,比例尺:1厘米(D)、(E)和(F)(B)中橙色虚线(左、中、右)的直径。
NM NP探针NIR-II荧光成像在体实验(图2)证明了其能够进行清晰的肿瘤及血管监测。
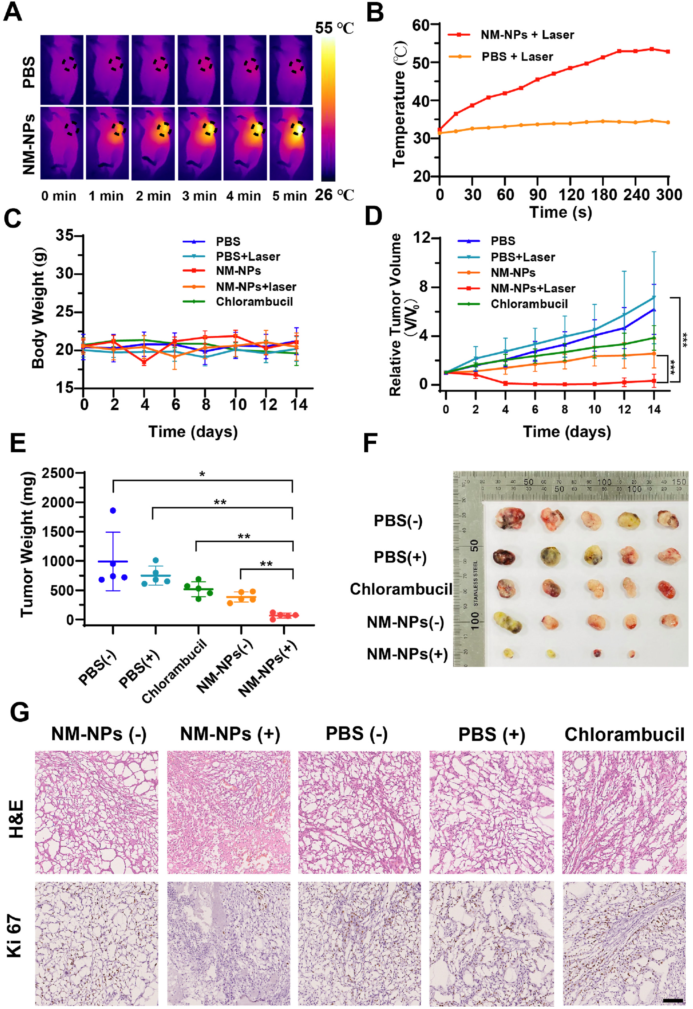
图3 NM NP的体内治疗 (A)在808nm激光照射(0.5 W·cm−2)(B)在808 nm激光照射下,以不同间隔记录用NM NP和PBS处理的A549荷瘤小鼠的肿瘤部位的温度。(C)治疗后14天小鼠的体重变化。(D)不同治疗的相对肿瘤生长曲线(n=5,***p<0.001)。(E)治疗14天后从不同组小鼠切除的肿瘤重量(n=4,***p<0.01,*p<0.1)。(F)第14天从不同组的小鼠切除的代表性肿瘤照片。(G) 各种治疗后肿瘤组织的H&E和Ki67染色图像。比例尺:100 μm。
对A549肺癌荷瘤小鼠进行了化学-光热协同治疗,记录肿瘤部位的温度(图3 A)。NM NPs+激光组肿瘤部位的温度迅速升高,达到53◦C、 相比之下,PBS+激光组的温度仅增加了3.3◦C(图3B)。在14天的治疗期间,每2天记录一次肿瘤体积和体重,表明化学光热治疗不会对小鼠造成任何明显的毒性副作用(图3C),图5D中,NM NPs+激光组的相对肿瘤体积显著减少,甚至一些小鼠肿瘤消失。而PBS和PBS+激光组中的肿瘤体积与NM NP和氯丙嗪组相比持续快速增加。两组NM NP和含氯丙嗪的化疗效果仅减缓肿瘤生长速度。此外,NM NPs组对肿瘤生长的控制优于氯丙嗪组。从所有组中切除的肿瘤重量表明,化学-光热协同治疗是治疗肿瘤的有效策略(图3E)。
收集治疗小鼠的主要器官,切片,并进行苏木精和伊红染色如图3G,肿瘤组织的H&E染色表明,NM NPs+激光组治疗导致高水平的细胞凋亡和坏死。Ki67免疫染色试验表明,在NM NPs+激光治疗组中,Ki67蛋白以低水平表达,表明化学-光热联合治疗有效地抑制了肿瘤细胞的增殖。结果表明,封装单个多功能分子的NM NPs纳米平台具有良好的生物安全性,具有广泛的应用前景。
烟台新药创制山东省实验室程震研究员为本研究通讯作者。
全文链接:https://doi.org/10.1016/j.biomaterials.2022.121670
(供稿部门:程震课题组;供稿人:索永宽)
用于NIR-II成像的有机单分子纳米平台肿瘤的化学光热协同治疗
2022-07-08 14:25
癌症是严重威胁人类健康的恶性疾病之一,也是致死的主要原因,氮芥作为烷化剂的发现开创了癌症化疗的发展。然而,由于癌细胞具有固有的DNA修复能力并产生耐药性,芥子氮衍生物产生的抗肿瘤作用可能会降低。
作为一种新兴的治疗方式,肿瘤光热治疗以无创和可控的方式靶向消融肿瘤组织。与具有长期体内毒性的无机光热剂相比,有机光热剂具有很高的临床应用潜力。但由于某些癌细胞具有获得的耐热性,仅用PTT治疗会留下微小的残留癌细胞,导致癌症复发。因此联合化疗和光热治疗的多功能光疗疗法是治疗肿瘤的有效方式。而先前报道的与化学光热疗法相结合的光疗材料的制备主要是通过将光热剂、荧光团和抗肿瘤药物如顺铂或阿霉素封装在一个纳米颗粒中,由于其成分复杂、重现性降低和药代动力学不确定,因此难以在临床中应用。
烟台新药创制山东省实验室程震研究员团队在肿瘤化学/光热治疗及生物应用领域取得最新进展。
研究者设计合成了一种新型化合物NM(如图1所示),该化合物将NIR-II FLI、化疗和光热处理能力整合到单分子系统中,合成了具有诊断功能和治疗的诊疗(Theranosic)探针。通过包封NM和两亲聚合物DSPE-PEG2000制备了水溶性NM基纳米颗粒(NM NP)以改善其疏水性。NM NP不仅具有超过1100nm的发射波长,并且作为具有深穿透深度和高时空分辨率的优秀NIRII荧光成像纳米探针,可以被应用于恶性肿瘤的协同化学光热治疗肿。生物相容性评估实验也证明了NM NP具有可忽略的生物毒性因此展现出重要的临床应用前景。
相关成果于2022年7月8日以“ Organic single molecule based nano-platform for NIR-II imaging and chemo-photothermal synergistic treatment of tumor”为题发表在国际知名学术期刊 Biomaterials上。

图1 用于NIR-II成像和光化学治疗的单分子纳米平台设计

图2 NM NP的NIR-II荧光成像特性 (A)在808nm激发光(160 mW·cm-2)下NM NP进行体内NIR-II荧光成像,1000 LP滤光片(左侧,100 ms曝光时间),1250 LP滤光片(中间,500 ms曝光时间,1400 LP滤光片(右侧,1000 ms曝光时间,比例尺:1 cm。(B)图为对(A)中所标记的橙色虚线上的荧光强度分布分析(C)小鼠右后肢的放大图像,比例尺:1厘米(D)、(E)和(F)(B)中橙色虚线(左、中、右)的直径。
NM NP探针NIR-II荧光成像在体实验(图2)证明了其能够进行清晰的肿瘤及血管监测。

图3 NM NP的体内治疗 (A)在808nm激光照射(0.5 W·cm−2)(B)在808 nm激光照射下,以不同间隔记录用NM NP和PBS处理的A549荷瘤小鼠的肿瘤部位的温度。(C)治疗后14天小鼠的体重变化。(D)不同治疗的相对肿瘤生长曲线(n=5,***p<0.001)。(E)治疗14天后从不同组小鼠切除的肿瘤重量(n=4,***p<0.01,*p<0.1)。(F)第14天从不同组的小鼠切除的代表性肿瘤照片。(G) 各种治疗后肿瘤组织的H&E和Ki67染色图像。比例尺:100 μm。
对A549肺癌荷瘤小鼠进行了化学-光热协同治疗,记录肿瘤部位的温度(图3 A)。NM NPs+激光组肿瘤部位的温度迅速升高,达到53◦C、 相比之下,PBS+激光组的温度仅增加了3.3◦C(图3B)。在14天的治疗期间,每2天记录一次肿瘤体积和体重,表明化学光热治疗不会对小鼠造成任何明显的毒性副作用(图3C),图5D中,NM NPs+激光组的相对肿瘤体积显著减少,甚至一些小鼠肿瘤消失。而PBS和PBS+激光组中的肿瘤体积与NM NP和氯丙嗪组相比持续快速增加。两组NM NP和含氯丙嗪的化疗效果仅减缓肿瘤生长速度。此外,NM NPs组对肿瘤生长的控制优于氯丙嗪组。从所有组中切除的肿瘤重量表明,化学-光热协同治疗是治疗肿瘤的有效策略(图3E)。
收集治疗小鼠的主要器官,切片,并进行苏木精和伊红染色如图3G,肿瘤组织的H&E染色表明,NM NPs+激光组治疗导致高水平的细胞凋亡和坏死。Ki67免疫染色试验表明,在NM NPs+激光治疗组中,Ki67蛋白以低水平表达,表明化学-光热联合治疗有效地抑制了肿瘤细胞的增殖。结果表明,封装单个多功能分子的NM NPs纳米平台具有良好的生物安全性,具有广泛的应用前景。
烟台新药创制山东省实验室程震研究员为本研究通讯作者。
全文链接:https://doi.org/10.1016/j.biomaterials.2022.121670
(供稿部门:程震课题组;供稿人:索永宽)